瑞士巴塞爾、北京和麻薩諸塞州劍橋--(BUSINESS WIRE)--(美國商業資訊)-- 跨國腫瘤學公司BeiGene, Ltd. (NASDAQ: BGNE; HKEX: 06160; SSE: 688235)今天公布了2023年第四季和全年業績及業務亮點,進一步強化其持續的全球擴張、全球和美國收入的快速成長以及創新的研發策略。
BeiGene董事長、共同創辦人兼執行長John V. Oyler表示:「BeiGene在第四季和2023年全年取得了長足進步,朝著成為具有影響力的下一代腫瘤創新企業的目標邁進。隨著BRUKINSA在由美國和歐洲領銜的全球市場繼續成功上市,我們鞏固了在血液學領域的領先地位。我們具有成本優勢的研發和生產使我們能夠建立起業界規模最大、最令人振奮的腫瘤產品線之一。我們期待著BeiGene在新的和現有的地區收入顯著成長的推動下,繼續實現卓越的營運。」
主要業務和產品線亮點
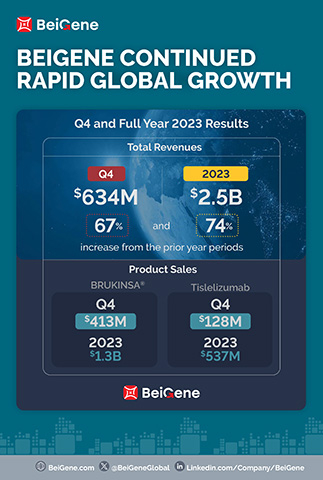
- 本季產品收入為6.305億美元,全年收入為22億美元,較去年同期分別成長了86%和75%;
- 對營運費用成長的嚴格管理使本季和全年的營運虧損按美國通用會計準則(GAAP)分別減少了18%和33%,按調整後的會計準則分別減少了28%和47%;
- 美國食品藥物管理局(FDA)核准對BRUKINSA的標籤進行更新,納入了在既往接受過治療的復發性或難治性(R/R)慢性淋巴細胞白血病(CLL)病患中,BRUKINSA與IMBRUVICA® (ibrutinib)進行比較的ALPINE第3期試驗的29.6個月中位隨訪無進展生存期(PFS)的優異結果,從而鞏固了BRUKINSA作為首選BTK抑制劑的地位;
- 歐盟委員會核准BRUKINSA用於治療既往接受過至少兩次系統治療的復發性/難治性濾泡性淋巴瘤(FL)成人病患,從而擴大了BRUKINSA的全球標籤範圍,使其成為第一個獲准用於該適應症的BTK抑制劑,也是同類產品中標籤範圍最廣的BTK抑制劑;
-
12月舉行的美國血液學會(ASH)年會公布的25篇論文摘要展示了該公司在血液學領域的領先地位和產品線的實力,其中包括:
- ALPINE試驗的最新結果顯示,在治療成人R/R CLL病患方面,BRUKINSA與IMBRUVICA相較,在中位隨訪39個月後的PFS持續保持優勢;
- sonrotoclax的1/2期試驗資料表明,聯用BRUKINSA具有安全性和耐受性,未經治療的CLL病患表現出強烈和持久的應答;該藥物對R/R邊緣區淋巴瘤病患有良好的單藥活性;與dexamethasone聯合使用,在帶有t(11,14)的多發性骨髓瘤(MM)病患中表現出有希望的療效和安全性;以及
- BTK CDAC BGB-16673的首次人體試驗資料顯示,在接受過大量預處理的B細胞惡性腫瘤病患(包括BTKi耐藥性病患)中,該藥具有顯著的臨床反應和可耐受的安全性。
- 擴大了抗PD-1抗體TEVIMBRA® (tislelizumab)的全球影響力,歐洲藥品管理局(EMA)人用藥品委員會(CHMP)給出了積極意見,推薦核准其作為非小細胞肺癌(NSCLC)三個適應症的治療方法,EMA接受了用於治療成人首次治療食管鱗狀細胞癌(ESCC)的資料遞交,以及在包括美國和歐洲在內的10個市場正在進行的監管審查;以及
- 推進創新研發策略,2023年將五個新分子實體(NME)投入臨床,包括潛在的同類最佳CDK4抑制劑BGB-43395。
2023年第四季和全年財務亮點
2023年第四季和全年收入分別為6.344億美元和25億美元,上年同期分別為3.801億美元和14億美元。與上年同期相較,本季總收入的成長主要歸因於公司主要市場的產品銷售成長。2023年第四季和全年,美國是公司收入最大的市場,收入分別為3.132億美元和11億美元,上年同期分別為1.554億美元和5.026億美元。隨著BRUKINSA在美國的銷售持續成長,公司預計這一趨勢將在2024年繼續保持不變。
|
|
|
截至12月31日的3個月 |
|
截至12月31日的12個月 |
||||||||
|
(單位:千美元,每股金額除外) |
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
產品淨收入 |
|
$ |
630,526 |
|
$ |
339,022 |
|
$ |
2,189,852 |
|
$ |
1,254,612 |
|
合作淨收入 |
|
$ |
3,883 |
|
$ |
41,073 |
|
$ |
268,927 |
|
$ |
161,309 |
|
總收入 |
|
$ |
634,409 |
|
$ |
380,095 |
|
$ |
2,458,779 |
|
$ |
1,415,921 |
|
|
|
|
|
|
|
|
|
|
||||
|
按GAAP計算的營運虧損 |
|
$ |
(383,795) |
|
$ |
(468,622) |
|
$ |
(1,207,736) |
|
$ |
(1,789,665) |
|
調整後營運虧損* |
|
$ |
(267,224) |
|
$ |
(372,480) |
|
$ |
(752,473) |
|
$ |
(1,420,225) |
|
|
|
|
|
|
|
|
|
|
||||
|
* 有關我們使用非GAAP財務指標的解釋,請參閱本新聞稿下文中的「非GAAP財務指標的使用」部分;有關各非GAAP財務指標與最具可比性的GAAP財務指標的調節,請參閱本新聞稿末尾的表格。 |
||||||||||||
2023年第四季和全年的產品收入分別為6.305億美元和22億美元,上年同期分別為3.39億美元和13億美元,其中包括:
- BRUKINSA 2023年第四季和全年的全球銷售額分別為4.13億美元和13億美元,上年同期分別為1.761億美元和5.647億美元;
- tislelizumab 2023年第四季和全年的銷售額分別為1.28億美元和5.366億美元,上年同期分別為1.022億美元和4.229億美元;
- 2023年第四季和全年,Amgen授權產品的銷售額分別為5110萬美元和1.883億美元,上年同期分別為2770萬美元和1.146億美元。
2023年第四季和全年的毛利率占全球產品銷售額的百分比分別為83.2%和82.7%,上年同期分別為78.3%和77.2%。季度較去年同期和年度較去年同期的毛利率比例均有所上升,原因是全球BRUKINSA的產品銷售組合比例高於我們產品組合中的其他產品,也高於利潤率較低的授權產品,以及BRUKINSA和tislelizumab的單位成本均有所降低。
營運支出
下表分別集中整理了2023年第四季和2022年第四季的營運支出:
|
|
|
GAAP |
|
|
|
非GAAP |
|
|
||||||||
|
(單位:千美元,百分比除外) |
|
2023年第四季 |
|
2022年第四季 |
|
百分比變化 |
|
2023年第四季 |
|
2022年第四季 |
|
百分比變化 |
||||
|
研發 |
|
$ |
493,987 |
|
$ |
446,023 |
|
11 % |
|
$ |
437,383 |
|
$ |
404,186 |
|
8% |
|
銷售、總務和行政 |
|
$ |
416,547 |
|
$ |
328,984 |
|
27 % |
|
$ |
361,435 |
|
$ |
275,648 |
|
31% |
|
攤銷(1) |
|
$ |
1,838 |
|
$ |
188 |
|
878 % |
|
$ |
— |
|
$ |
— |
|
NM |
|
營運支出總額 |
|
$ |
912,372 |
|
$ |
775,195 |
|
18 % |
|
$ |
798,818 |
|
$ |
679,834 |
|
18% |
下表分別集中整理了2023年和2022年全年的營運支出:
|
|
|
GAAP |
|
|
|
非GAAP |
|
|
||||||||
|
(單位:千美元,百分比除外) |
|
2023會計年度 |
|
2022會計年度 |
|
百分比變化 |
|
2023會計年度 |
|
2022會計年度 |
|
百分比變化 |
||||
|
研發 |
|
$ |
1,778,594 |
|
$ |
1,640,508 |
|
8% |
|
$ |
1,558,960 |
|
$ |
1,474,919 |
|
6% |
|
銷售、總務和行政 |
|
$ |
1,504,501 |
|
$ |
1,277,852 |
|
18% |
|
$ |
1,284,689 |
|
$ |
1,077,977 |
|
19% |
|
攤銷(1) |
|
$ |
3,500 |
|
$ |
751 |
|
366% |
|
$ |
— |
|
$ |
— |
|
NM |
|
營運支出總額 |
|
$ |
3,286,595 |
|
$ |
2,919,111 |
|
13% |
|
$ |
2,843,649 |
|
$ |
2,552,896 |
|
11% |
|
(1)與BMS產品經銷權的無形資產有關,該無形資產已於2023年12月31日攤銷完畢,屆時根據和解協議的條款,經銷權將歸還BMS。 |
||||||||||||||||
2023年第四季和全年的研發(R&D)支出與上年同期相較,按GAAP和調整後基數計算均有所增加,主要原因是投資於新平台/模式,將臨床前專案推進到臨床,以及將早期臨床專案推進到後期。2023年第四季和全年,與正在進行中的研發相關的、針對引進授權資產的預付費用分別為3180萬美元和4680萬美元,上年同期分別為4870萬美元和6870萬美元。
與上年同期相較,2023年第四季和全年的銷售、總務和行政(SG&A)支出在GAAP和調整後基礎上都有所增加,這要歸因於持續投資於BRUKINSA在全球的商業推廣,主要是在美國和歐洲。
淨虧損
與上年同期相較,2023年第四季和全年的GAAP淨虧損均有所改善,這主要歸因於營運虧損減少以及2023年全年與BMS仲裁和解相關的非營運收益達到3.629億美元。
2023年第四季,每股淨虧損為0.27美元,每股美國存托憑證(ADS)淨虧損為3.53美元,而上年同期每股淨虧損為0.33美元,每股ADS為4.29美元。2023年全年每股淨虧損為0.65美元,每股ADS淨虧損為8.45美元,上年同期每股淨虧損為1.49美元,每股ADS淨虧損為19.43美元。
|
現金、現金等價物和受限現金 |
||||
|
|
截至12月31日的年度 |
|||
|
|
|
2023 |
|
2022 |
|
|
(單位:千美元) |
|||
|
期初現金、現金等價物和受限現金 |
$ |
3,875,037 |
$ |
4,382,887 |
|
營運活動使用的現金淨額 |
|
(1,157,453) |
|
(1,496,619) |
|
投資活動提供的現金淨額 |
|
60,004 |
|
1,077,123 |
|
融資活動提供(使用)的現金淨額 |
|
416,478 |
|
(18,971) |
|
匯率變動的淨影響 |
|
(8,082) |
|
(69,383) |
|
現金、現金等價物和受限現金減少淨額 |
|
(689,053) |
|
(507,850) |
|
期末現金、現金等價物和受限現金 |
$ |
3,185,984 |
$ |
3,875,037 |
2023年第四季和全年的營運所用現金分別為2.216億美元和12億美元,上年同期分別為3.182億美元和15億美元,這主要歸功於營運槓桿率的提高。
有關BeiGene 2023年財務報表的更多詳情,請參閱BeiGene向美國證券交易委員會遞交的2023年10-K表年報。
監管進展與開發計畫
主要亮點
- BRUKINSA作為首選BTK抑制劑的地位得到鞏固,FDA更新了其PFS優越性標籤,同時在歐洲和加拿大獲得治療R/R FL的核准
- 擴大TEVIMBRA的全球涵蓋範圍,在包括美國和歐洲在內的10個市場的監管申請正在審批中
- 在針對BTK CDAC具有註冊潛力的一線CLL治療和擴展佇列中,已經開始招募首批病患進行sonrotoclax的全球第3期試驗
|
類別 |
資產 |
近期里程碑 |
|
監管核准 |
BRUKINSA |
|
|
TEVIMBRA |
|
|
|
監管遞交 |
Tislelizumab |
|
|
臨床活動 |
BRUKINSA |
|
|
Tislelizumab |
|
|
|
Sonrotoclax |
|
|
|
BTK CDAC |
|
|
|
抗-LAG3 |
|
|
|
早期開發
|
|
預計即將實現的里程碑
主要亮點
- BRUKINSA與obinutuzumab聯合治療R/R FL獲得FDA核准,使其成為同類產品中標籤最寬的BTK抑制劑
- tislelizumab作為一線和二線ESCC治療獲得FDA核准,顯示創新性實體瘤產品組合在全球得到擴展
|
類別 |
資產 |
預期里程碑 |
|
預期獲得的監管核准 |
BRUKINSA |
|
|
Tislelizumab |
|
|
|
預計遞交的監管文件 |
BRUKINSA |
|
|
Tislelizumab |
|
|
|
Zanidatamab 2 |
|
|
|
預期臨床活動 |
Sonrotoclax |
|
|
Ociperlimab |
|
|
|
Tarlatamab 3 |
|
|
|
早期開發 |
|
|
|
1Leads Biolabs合作;BeiGene擁有除中國以外的商業權利 |
||
|
2與Jazz/Zymeworks合作;BeiGene擁有亞太地區(日本除外)、澳洲、紐西蘭的商業權 |
||
|
3與Amgen合作;BeiGene將擁有在中國的商業權利,並對中國以外的淨銷售額收取中個位數的分級版稅 |
||
|
4XmAb®是Xencor, Inc.的注冊商標 |
||
生產營運
- 位於紐澤西州霍普韋爾的普林斯頓西部創新園區(Princeton West Innovation Campus)耗資8億美元的美國旗艦生物製劑生產和臨床研發設施即將竣工,可望於2024年7月運行;該園區的可開發房地產總面積超過100萬平方英尺,可供未來擴建;
- 在中國蘇州建成新的小分子生產園區。一期工程增加了55.9萬多平方英尺的面積,並將年產能擴大到10億個固體製劑單位;以及
- 我們在中國廣州最先進的生物製劑工廠建成了25萬平方英尺的ADC生產設施和17萬平方英尺的額外生物製劑臨床生產能力,使總產能達到6.5萬公升。
企業發展
- 從Ensem Therapeutics, Inc.獲得了差異化CDK2抑制劑的全球獨家授權,補充了公司在乳癌和其他實體瘤領域的早期開發研發產品線。
|
財務摘要 |
|||||
|
精選簡明合併資產負債表資料(美國GAAP) |
|||||
|
(單位:千美元) |
|||||
|
|
截至 |
||||
|
|
12月31日 |
|
12月31日 |
||
|
|
|
2023 |
|
|
2022 |
|
|
(經稽核) |
||||
|
資產: |
|
|
|
||
|
現金、現金等價物、受限現金和短期投資 |
$ |
3,188,584 |
|
$ |
4,540,288 |
|
應收帳款淨額 |
|
358,027 |
|
|
173,168 |
|
存貨淨額 |
|
416,122 |
|
|
282,346 |
|
財產、廠房和裝置淨額 |
|
1,324,154 |
|
|
845,946 |
|
總資產 |
$ |
5,805,275 |
|
$ |
6,379,290 |
|
負債和權益 |
|
|
|
||
|
應付帳款 |
$ |
315,111 |
|
$ |
294,781 |
|
應計費用和其他應付款 |
|
693,731 |
|
|
467,352 |
|
遞延收入 |
|
300 |
|
|
255,887 |
|
研發成本分攤 |
|
238,666 |
|
|
293,960 |
|
債務 |
|
885,984 |
|
|
538,117 |
|
負債總額 |
|
2,267,948 |
|
|
1,995,935 |
|
總股本 |
$ |
3,537,327 |
|
$ |
4,383,355 |
|
簡明合併營運報表(美國GAAP) |
|||||||||||
|
(單位:千美元,股票、美國存托憑證(ADS)、每股和每ADS資料除外) |
|||||||||||
|
|
截至 12月31日的三個月 |
|
截至 12月31日的12個月 |
||||||||
|
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
|
(未經稽核) |
|
(經稽核) |
||||||||
|
收入 |
|
|
|
|
|
|
|
||||
|
產品淨收入 |
$ |
630,526 |
|
$ |
339,022 |
|
$ |
2,189,852 |
|
$ |
1,254,612 |
|
合作收入 |
|
3,883 |
|
|
41,073 |
|
|
268,927 |
|
|
161,309 |
|
總收入 |
|
634,409 |
|
|
380,095 |
|
|
2,458,779 |
|
|
1,415,921 |
|
產品銷售成本 |
|
105,832 |
|
|
73,522 |
|
|
379,920 |
|
|
286,475 |
|
毛利潤 |
|
528,577 |
|
|
306,573 |
|
|
2,078,859 |
|
|
1,129,446 |
|
營運費用 |
|
|
|
|
|
|
|
||||
|
研發 |
|
493,987 |
|
|
446,023 |
|
|
1,778,594 |
|
|
1,640,508 |
|
銷售、總務和行政 |
|
416,547 |
|
|
328,984 |
|
|
1,504,501 |
|
|
1,277,852 |
|
無形資產攤銷 |
|
1,838 |
|
|
188 |
|
|
3,500 |
|
|
751 |
|
營運支出總額 |
|
912,372 |
|
|
775,195 |
|
|
3,286,595 |
|
|
2,919,111 |
|
營運虧損 |
|
(383,795) |
|
|
(468,622) |
|
|
(1,207,736) |
|
|
(1,789,665) |
|
利息收入淨額 |
|
16,274 |
|
|
18,219 |
|
|
74,009 |
|
|
52,480 |
|
其他收入(支出)淨額 |
|
16,749 |
|
|
19,438 |
|
|
307,891 |
|
|
(223,852) |
|
所得稅前虧損 |
|
(350,772) |
|
|
(430,965) |
|
|
(825,836) |
|
|
(1,961,037) |
|
所得稅費用 |
|
16,781 |
|
|
14,370 |
|
|
55,872 |
|
|
42,778 |
|
淨虧損 |
|
(367,553) |
|
|
(445,335) |
|
|
(881,708) |
|
|
(2,003,815) |
|
|
|
|
|
|
|
|
|
||||
|
每股淨虧損 |
$ |
(0.27) |
|
$ |
(0.33) |
|
$ |
(0.65) |
|
$ |
(1.49) |
|
已發行加權平均股數—基本股和稀釋股 |
|
1,353,005,058 |
|
|
1,348,916,108 |
|
|
1,357,034,547 |
|
|
1,340,729,572 |
|
|
|
|
|
|
|
|
|
||||
|
每股美國存托憑證(「ADS」)淨虧損 |
$ |
(3.53) |
|
$ |
(4.29) |
|
$ |
(8.45) |
|
$ |
(19.43) |
|
已發行加權平均ADS—基本和稀釋 |
|
104,077,312 |
|
|
103,762,778 |
|
|
104,387,273 |
|
|
103,133,044 |
關於使用非GAAP財務指標的說明
BeiGene提供了某些非GAAP財務指標,包括調整後營運支出和調整後營運虧損以及某些其他非GAAP損益表細列項目,每個項目都包括對GAAP數位的調整。這些非GAAP財務指標旨在提供有關BeiGene經營業績的更多資訊。對BeiGene GAAP資料的調整酌情不包括非現金項目,如股權激勵、折舊和攤銷。如果某些其他特殊項目或重大事件在發生期間規模較大,也會定期納入非GAAP調整。BeiGene有一套既定的非GAAP政策,用於指導確定非GAAP財務指標中不包括的成本,以及使用此類指標的相關協議、控制和核准。BeiGene相信,將這些非GAAP與GAAP數位結合起來考慮,可以加深對BeiGene經營業績的全面瞭解。納入非GAAP財務指標的目的是為了讓投資人更全面地瞭解公司的歷史和預期財務結果和趨勢,並便於在不同時期之間進行關於預測資訊的比較。此外,這些非GAAP財務指標也是BeiGene管理層用於規劃和預測目標以及衡量公司業績的指標之一。這些非GAAP財務指標應視為對按照GAAP計算的財務指標的補充,而不是替代或優於這些財務指標。公司使用的非GAAP財務指標的計算方法可能與其他公司使用的非GAAP財務指標不同,因此可能不具有可比性。
|
選定GAAP指標與非GAAP指標的調節 |
||||||||||||
|
(單位:千美元,每股金額除外) |
||||||||||||
|
(未經稽核) |
||||||||||||
|
|
|
截至12月31日的3個月 |
|
截至12月31日的12個月 |
||||||||
|
|
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
調整後產品銷售成本的GAAP調節: |
|
|
|
|
|
|
|
|
||||
|
GAAP產品銷售成本 |
|
$ |
105,832 |
|
$ |
73,522 |
|
$ |
379,920 |
|
$ |
286,475 |
|
減去:折舊 |
|
|
1,898 |
|
|
— |
|
|
8,578 |
|
|
— |
|
減去:無形資產攤銷 |
|
|
1,119 |
|
|
781 |
|
|
3,739 |
|
|
3,225 |
|
調整後的產品銷售成本 |
|
$ |
102,815 |
|
$ |
72,741 |
|
$ |
367,603 |
|
$ |
283,250 |
|
|
|
|
|
|
|
|
|
|
||||
|
調整後研發費用的GAAP調節: |
|
|
|
|
|
|
|
|
||||
|
GAAP研發 |
|
$ |
493,987 |
|
$ |
446,023 |
|
$ |
1,778,594 |
|
$ |
1,640,508 |
|
減去:股權激勵支出 |
|
|
39,424 |
|
|
34,966 |
|
|
163,550 |
|
|
139,348 |
|
減去:折舊 |
|
|
17,180 |
|
|
6,871 |
|
|
56,084 |
|
|
26,241 |
|
調整後的研發 |
|
$ |
437,383 |
|
$ |
404,186 |
|
$ |
1,558,960 |
|
$ |
1,474,919 |
|
|
|
|
|
|
|
|
|
|
||||
|
調整後銷售、總務和行政的GAAP調節: |
|
|
|
|
|
|
|
|
||||
|
GAAP銷售、總務和行政 |
|
$ |
416,547 |
|
$ |
328,984 |
|
$ |
1,504,501 |
|
$ |
1,277,852 |
|
減去:股權激勵支出 |
|
|
53,328 |
|
|
43,160 |
|
|
204,038 |
|
|
163,814 |
|
減去:折舊 |
|
|
1,784 |
|
|
10,176 |
|
|
15,774 |
|
|
36,061 |
|
調整後的銷售、總務和行政 |
|
$ |
361,435 |
|
$ |
275,648 |
|
$ |
1,284,689 |
|
$ |
1,077,977 |
|
|
|
|
|
|
|
|
|
|
||||
|
調整後營運支出的GAAP調節 |
|
|
|
|
|
|
|
|
||||
|
GAAP營運費用 |
|
|
912,372 |
|
|
775,195 |
|
|
3,286,595 |
|
|
2,919,111 |
|
減去:股權激勵支出 |
|
|
92,752 |
|
|
78,126 |
|
|
367,588 |
|
|
303,162 |
|
減去:折舊 |
|
|
18,964 |
|
|
17,047 |
|
|
71,858 |
|
|
62,302 |
|
減去:無形資產攤銷 |
|
|
1,838 |
|
|
188 |
|
|
3,500 |
|
|
751 |
|
調整後的營運支出 |
|
$ |
798,818 |
|
$ |
679,834 |
|
$ |
2,843,649 |
|
$ |
2,552,896 |
|
|
|
|
|
|
|
|
|
|
||||
|
調整後營運虧損的GAAP調節: |
|
|
|
|
|
|
|
|
||||
|
GAAP營運虧損 |
|
$ |
(383,795) |
|
$ |
(468,622) |
|
$ |
(1,207,736) |
|
$ |
(1,789,665) |
|
加上:股權激勵支出 |
|
|
92,752 |
|
|
78,126 |
|
|
367,588 |
|
|
303,162 |
|
加上:折舊 |
|
|
20,862 |
|
|
17,047 |
|
|
80,436 |
|
|
62,302 |
|
加上:無形資產攤銷 |
|
|
2,957 |
|
|
969 |
|
|
7,239 |
|
|
3,976 |
|
調整後的營運虧損 |
|
$ |
(267,224) |
|
$ |
(372,480) |
|
$ |
(752,473) |
|
$ |
(1,420,225) |
|
|
|
|
|
|
|
|
|
|
||||
請注意,由於四捨五入,上述數位之和可能不完全相等
關於百濟神州
BeiGene是一家全球性腫瘤學公司,專注于發現和開發創新的腫瘤治療方法,旨在讓全球癌症病患治療更加負擔得起且易於獲得。憑藉我們廣泛的產品組合,我們正透過內部能力和合作關係加速開發多元化的新型療法。我們致力於從根本上改善更多需要藥物的病患的藥物取得途徑。我們日益壯大的全球團隊已超過1萬名同事,遍佈五大洲,並在巴塞爾、北京和美國劍橋設有行政辦公室。如欲瞭解更多有關BeiGene的更多資訊,請造訪www.beigene.com並在LinkedIn和X(前身為Twitter)上關注我們。
前瞻性聲明
本新聞稿包含《1995年私人證券訴訟改革法案》和其他聯邦證券法定義的前瞻性陳述,包括有關以下事項的陳述:BeiGene成為具有影響力的下一代腫瘤學創新企業的進展;BeiGene腫瘤學產品線的未來;BeiGene在新的和現有的地區(特別是在美國)實現收入成長的能力;公司在建生產設施的預期產能和竣工日期以及這些設施提高生產能力的潛力;BeiGene的預期監管審批、遞交材料和臨床活動;以及「關於BeiGene」標題下所描述的BeiGene的計畫、承諾、願望和目標。實際結果可能由於各種重要因素而與前瞻性陳述中所指的結果大相逕庭,包括BeiGene證明其藥物候選產品的療效和安全性的能力;其藥物候選產品的臨床結果可能不支持進一步的開發或獲得市場核准;主管機關的行動可能影響臨床試驗和市場核准的開始、時機和進展;BeiGene的上市藥物和獲准的藥物候選產品實現商業成功的能力;BeiGene獲得並維護其藥物和科技智慧財產權保護的能力;BeiGene依賴第三方進行藥物開發、製造、商業化和其他服務;BeiGene在獲得監管核准和實現製藥產品商業化方面的經驗有限;BeiGene獲得額外營運資金和完成藥物候選產品開發以及實現及維持盈利的能力;以及在BeiGene最近的10-K表年度報告中的「風險因素」部分更全面討論的那些風險,以及BeiGene在隨後向美國證券交易委員會遞交的文件中討論的潛在風險、不確定性和其他重要因素。本新聞稿中的所有資訊均為本新聞稿發表當日的資訊,除非法律要求,否則BeiGene無義務更新此類資訊。
IMBRUVICA®是Pharmacyclics LLC的注冊商標。
免責聲明:本公告之原文版本乃官方授權版本。譯文僅供方便瞭解之用,煩請參照原文,原文版本乃唯一具法律效力之版本。